ミッションと概要
当研究室では、BRCが各リソース、特に実験動物および幹細胞をより高度なクオリティにて維持供給するために必要な遺伝関連技術開発を行う。
また、これらの技術が広く研究コミュニティに活用されるべく、研修事業を行う。
技術開発
研究内容 2016年版
1.体細胞核移植クローン技術の開発
本年度は、 初期胚におけるエピゲノム情報を得るために、以下の研究を行った。着床前時期においてゲノムの足場であるヒストンが
ダイナミックに置換される現象に着目し,これを制御するCAF-1タンパク質の機能を解析するためにCAF-1のノックダウンを行った。
その結果、CAF-1ノックダウンした着床前胚においてレトロトランスポゾン(RT)の脱抑制が引き起こされ致死となることが明らかになった (図1)。
このノックダウン胚に逆転写酵素阻害剤を添加すると胚の生存率が大幅に改善することがわかった。さらに解析を進めていくと、
RT領域には抑制性のヒストン修飾が豊富であり、CAF-1によるH3K9me3とH4K20me3の蓄積がRTの抑制に重要であることが示された。
以上より、CAF-1 はRT領域のH3.1の蓄積に必須であり、抑制性ヒストン修飾のH3K9me3とH4K20me3を蓄積させることで RT の転写を抑制することが
明らかになった (図2)。
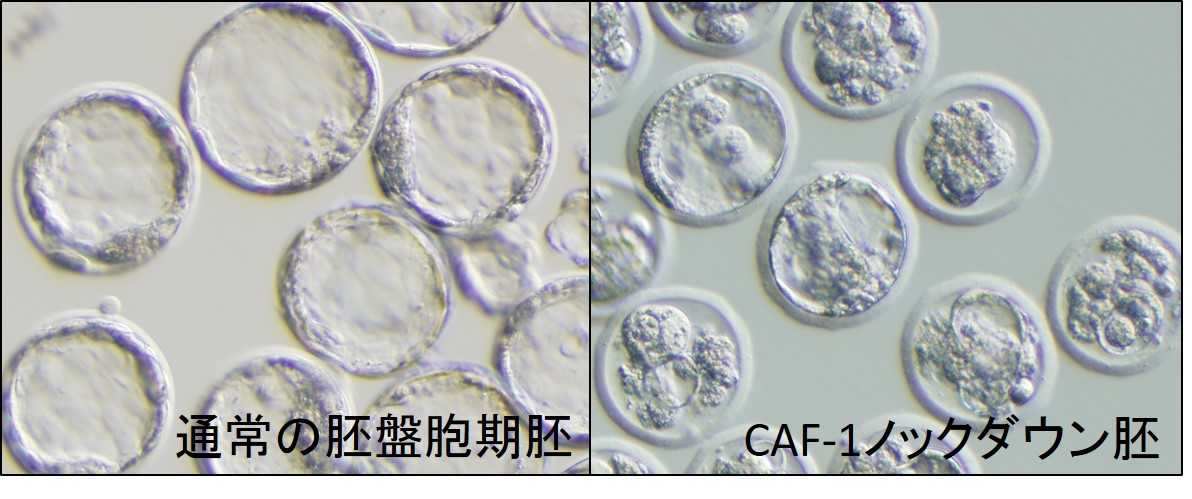
図1. CAF-1ノックダウン胚における胚性致死
胚盤胞期となる受精後4日目の写真。左が通常の胚、右はCAF-1ノックダウン胚。
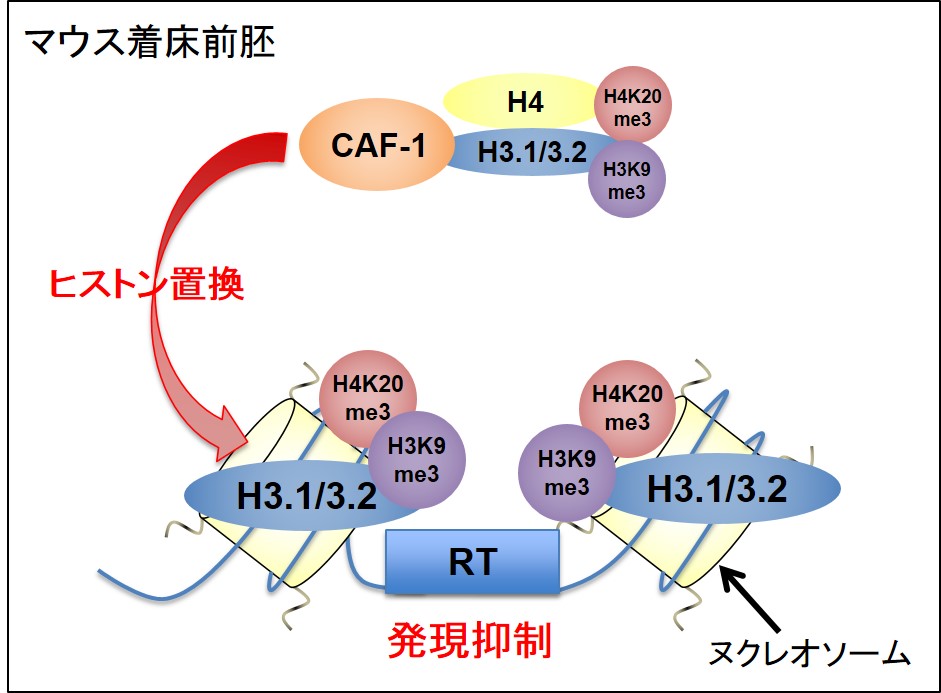
図2. CAF-1によるレトロトランスポゾン抑制機構の模式図
マウス129/Sv系統(129)は、近交系でありながら、胚性幹細胞の樹立効率や、体細胞核移植クローンの産仔率が高いなど、高いゲノム可塑性を有する系統として知られている。この高いゲノム可塑性を司っているゲノム領域を同定する目的で、バックグラウンドがC57BL6系統で一部の染色体のみが129に置換されたコンソミック系統を複数用いて体細胞クローン産仔の作出を行った結果、内1系統で129の特徴を示すクローン産仔が得られた。今後は、候補となる遺伝子の絞り込みを行う予定である。
2.顕微授精技術の開発
マーモセット幼若雄個体を用いた顕微授精技術を確立するために、各発生段階の精子細胞の出現時期の特定および各発生段階の精子細胞の卵子活性化能の検定を行った。 精巣の組織学的および細胞学的観察より生後8ヶ月齢で精母細胞、 10− 11ヶ月齢で初期精子細胞が出現することが明らかになった。マーモセット各精子細胞をマウス卵子へ注入し、その卵子の活性化を観察した結果、 初期円形精子細胞は卵子活性化能を持たないが、後期円形精子細胞は卵子活性化能を持つことが明らかになった。後期円形精子細胞以降の精子細胞を顕微授精に用いることで超スピードコンジェニック法による遺伝子改変マーモセット系統の作出に期待できる。
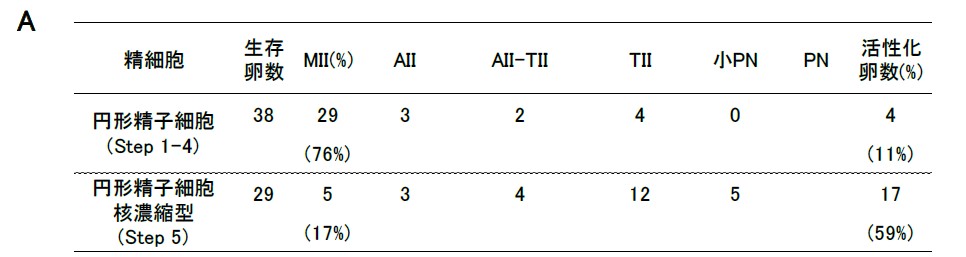
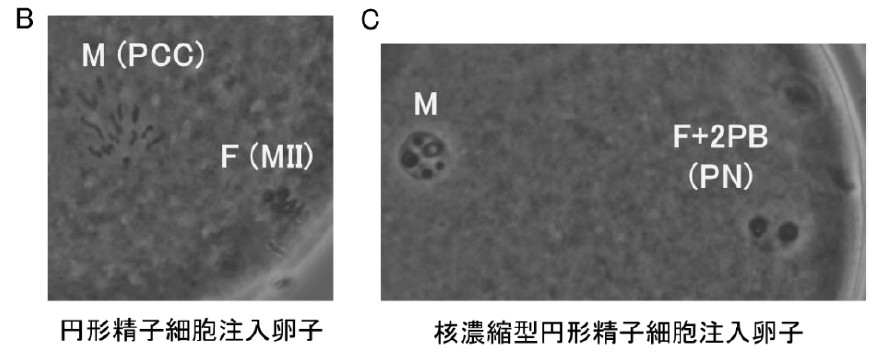
図3. マーモセット円形精子細胞注入後のマウス卵子活性化の観察(A)。
核濃縮型の後期円形精子細胞を用いることにより、半数以上の卵子が活性化することが明らかになった。
活性化しなかった卵子ではマーモセット円形精子細胞核はpremature chromosome condensation (PCC)
を示していた(B)。活性化した卵子では雄性前核を形成した(C)。
3.効率的な胚・配偶子の凍結保存法の開発
新規開発した性周期の同期化と抗インヒビン血清(AIS)による過排卵誘起法は、C57BL/6、BALB/c、ICR、B6D2F1系統の成熟マウス(10-20 週齢)において従来法(eCG-hCG)よりも正常卵子数が3-4 倍であり、15ヶ月齢でも2倍と、幅広い系統と週齢に効果的であった(図4)。AやB10背景系統でも約3倍の正常卵数が得られ、体外受精が困難なB10背景系統では凍結精子用の培養液により受精率が6-8% から85-92%に急上昇した。胚移植が困難なA背景系統では前核期で一度胚移植し、2細胞期胚をガラス化保存-回収後に胚移植して約30%が産子へ発育した。各生殖工学技術が困難な系統でも大幅に成績が改善された。
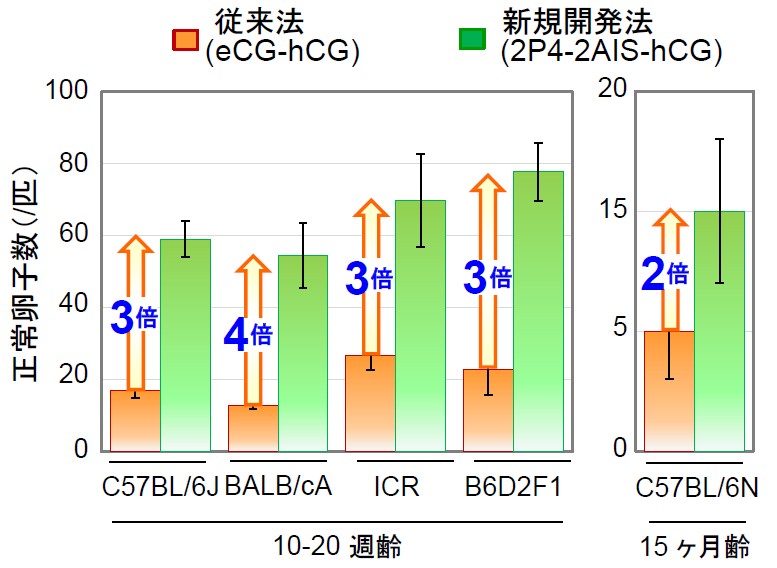
図4. 様々な系統における過排卵誘起の成績
4.新規幹細胞の確立
ヘテロな細胞集団であるtrophoblast stem cell (TS細胞)が幹細胞として維持されるメカニズムを明らかにするために、コロニータイプ別の遺伝子発現とキメラ形成能の解析を行った。解析には、B6またはICR由来の株を用いた。コロニータイプは、TS細胞のコロニー形態によりtype 1からtype 5の5種類に分類した (図5)。それぞれのコロニーは、type 1 (ドーム型のコンパクトコロニー)、type 2 ( 扁平型のコンパクトコロニー)、type 3 ( 中心部分にクラスターを形成するType 2様コロニー)、type 4 ( 細胞同士の接着が弱いコロニー)、type 5 ( 扁平だが、敷石状で個々の細胞が明瞭なコロニー)と、形態学的に異なる特徴を持っていた。Time-lapse imagingにより、偽足を持つ小型不定形の細胞からドーム型のコロニーが形成されること、全てのコロニータイプはtype 1から派生することが明らかとなった。さらに、キメラ形成能の解析により、type 1と type 2は同等のキメラ形成能を持っており、type 4はキメラ形成能が著しく低下したコロニーであることが示された。また、Cdx2 よりもElf5がより鋭敏な未分化マーカーであることを明らかにした。以上の検討により、type 1コロニーが最も未分化な状態のコロニーであることが明らかとなった。
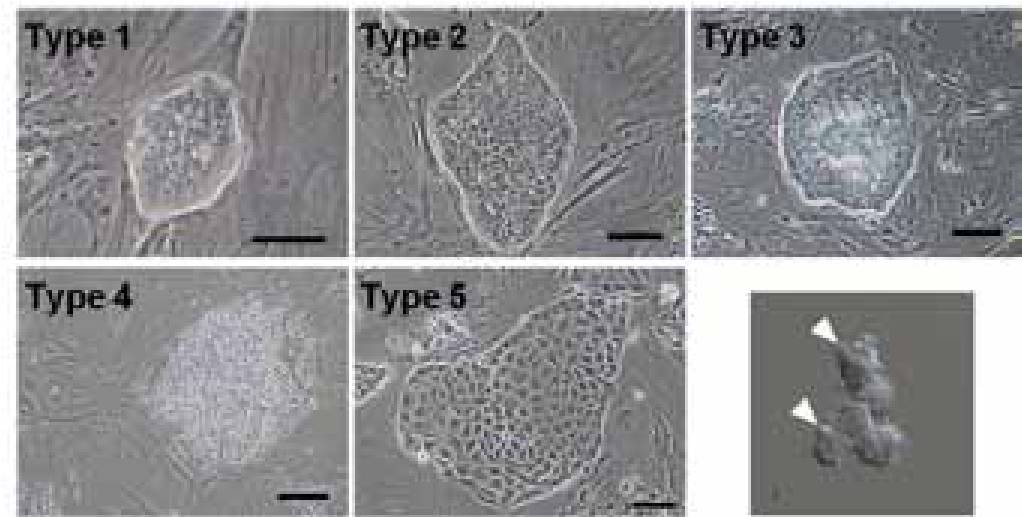
図5. マウスtrophoblast stem cell に現れるコロニー。コロニータイプの変遷や遺伝子解析により、
type 1 が最も未分化なコロニーであることがわかった。右下は、type 1 コロニーを構成する細胞。
不定形で、偽足(矢頭)をもつ。
5.技術研修
平成26年度および27年度において、所外からの研修生を対象に以下の研修を行った。
- 26年10月 「マウス精子・胚の凍結保存方法に関する技術研修」
- 27年8月 「マウス胚の灌流採取と移植に関する技術研修」
- 27年11月 「マウス顕微授精技術に関する技術研修」
