ミッションと概要
当研究室では、BRCが各リソース、特に実験動物および幹細胞をより高度なクオリティにて維持供給するために必要な遺伝関連技術開発を行う。
また、これらの技術が広く研究コミュニティに活用されるべく、研修事業を行う。
技術開発
研究内容
1.体細胞核移植クローン技術の開発
我々は、マウスクローン胚の発生低下の原因を探るために、胚盤胞期胚の大規模な遺伝子発現解析を行った。その結果、
(1)マウスクローン胚ではX染色体の遺伝子発現が広範囲で抑制されていること(図1赤線)、
(2)X染色体の不活性化を司るXist遺伝子の異所性発現がX染色体発現抑制に大きく関わっていること(図1緑線)、
(3)Xist遺伝子をノックアウトすることでクローン効率が劇的に改善されることを明らかにした(図2)。
一方、Xist遺伝子非依存的に生じるX染色体XqA7.2/F3領域の遺伝子発現低下も認められた。そこでドナー卵丘細胞を用いたChIP-on-chip解析とGEOデータ(Wen et al., GSE13445)によるin silico解析を行ったところ、当該領域に抑制性のヒストン修飾(H3K9me2)が高度に蓄積していることが明らかとなり、新たな再プログラム化阻害因子を見出す事に成功した。
現在、哺乳動物全般に汎用性のあるXist遺伝子の制御方法を開発する目的で、RNA干渉によるクローン作出を試みている。
Inoue K, Kohda T, Sugimoto M, Sado T, Ogonuki N, Matoba S, Shiura H, Ikeda R, Mochida K, Fujii T, Sawai K, Otte AP,
Tian XC, Yang X, Ishino F, Abe K, Ogura A. Impeding Xist expression from the active X chromosome improves mouse somatic
cell nuclear transfer. Science 330: 496-499, 2010.
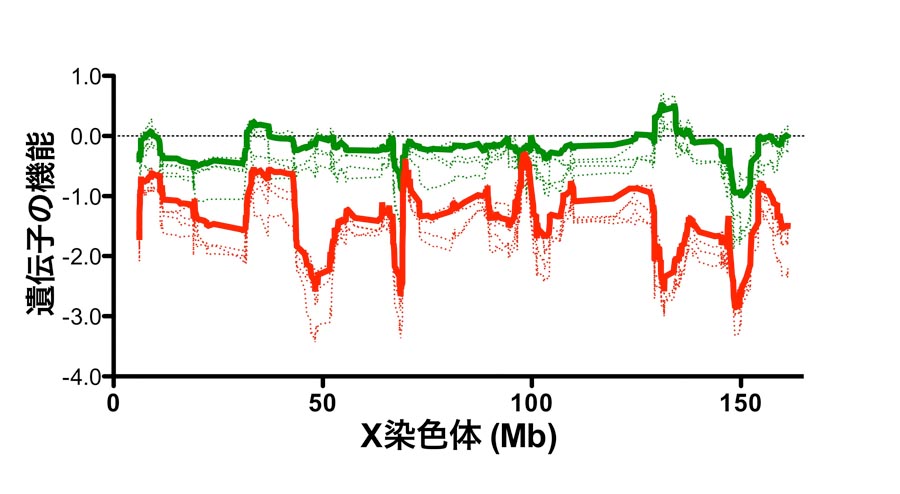
図1. マウス体細胞クローン胚盤胞期胚におけるX染色体遺伝子発現パターン
体細胞クローン胚(赤ライン)の遺伝子機能は受精卵(グラフ中の0値)と比較すると
大きく低下している。
一方で、Xist遺伝子を欠損させた体細胞から作製されたクローン胚(緑ライン)では
ほとんどの領域で遺伝子機能が回復している。
![]()
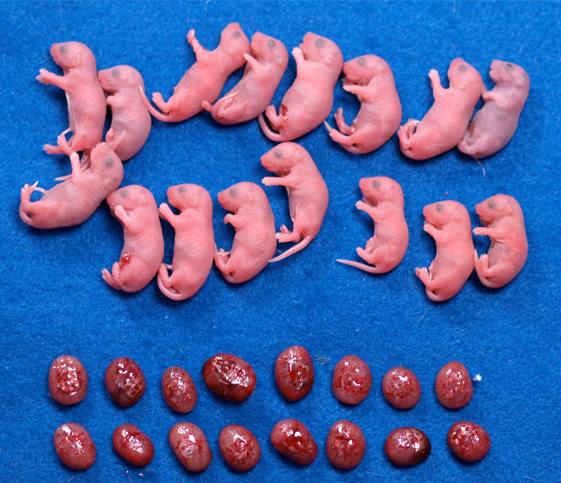
図2. Xist遺伝子を欠損させた体細胞から作製されたクローンマウス
X染色体の機能が回復するため、通常の方法(左)より多くのクローンマウスが産まれる(右)。
2.顕微授精技術の開発
(1) マウス顕微授精における系統、精子成熟度、凍結保存の影響に関する統計学的解析
マウス顕微授精は極めて応用範囲の広い技術である。マウス顕微授精の効率は、用いる系統や精子の成熟度など、多くの因子に影響されることが経験的に知られているが統計解析はほとんど行われていない。顕微授精に影響する因子を明らかにするために、(5系統)×(3種の精子・精子細胞)×(その凍結の有無)の30通りの顕微授精実験を行い、三元分散分析を実施した。その結果、顕微授精の効率は全ての発生段階において系統、精子成熟度あるいはその組み合わせが影響していること、細胞の凍結は胚発生に影響しないなど、多くの有意な統計学的データベースが蓄積できた。
Ogonuki N, Mori M, Shinmen A, Inoue K, Mochida K, Ohta A, Ogura A. The effect on intracytoplasmic sperm injection outcome of genotype, male germ cell stage and freeze-thawing in mice. PLoS ONE, 5(6): e11062. doi:10.1371/journal.pone.0011062
(2) 人為的活性化処理なしでの凍結円形精子細胞の顕微注入によるマウス産仔の作出
マウス雄性生殖細胞の卵子活性化能は、伸張精子細胞から精子に成熟するにしたがって獲得されることが知られている。よってまだ卵子活性化能を獲得していない円形精子細胞を受精に用いる場合は卵子への人為的活性化処理が必須である。しかしながら凍結保存した円形精子細胞は人為的活性化処理なしで産仔が得られる(5-27%)ことが明らかになった。凍結円形精子細胞による卵子活性化の原因は、凍結融解操作によって細胞浮遊液中の精子・伸長精子細胞のsperm factorが流出して円形精子細胞に取り込まれている可能性が考えられた。本実験により凍結円形精子細胞を顕微授精に用いる場合は人為的卵子活性化処理を行う必要がないことが示唆された。また凍結円形精子細胞の卵子活性化能を検定する場合には留意する必要がある。
Ogonuki N, Inoue K, Ogura A. Birth of normal mice following round spermatid injection without artificial oocyte activation. J Reprod Dev 57: 534-538, 2011
(3) マウス始原生殖細胞(PGC)から機能的な雌雄配偶子の作出
哺乳動物では、生殖細胞は胚発生の初期に始原生殖細胞(PGC)として出現した後、周囲の体細胞の影響を受けながら、雌雄の性分化、減数分裂による半数体化、さらにはエピジェネティックなゲノム修飾など、複雑な分化成熟を経て配偶子を形成する。この複雑な過程を人為的に再現すべく、これまで多くの検討がなされてきたが、PGCから機能的な配偶子を得るin vitro培養系は雌雄ともに存在していない。
そこで我々は、マウスをモデルとして、胎仔生殖腺の体細胞を利用したin vivo移植系による配偶子作出法を検討した。 胎齢12.5日目の胚から雌雄PGCを単離し、同時期かつ同性の生殖腺体細胞と再凝集塊を形成させ、腎臓被膜下へ移植した結果、移植4週後にはそれぞれ精巣と卵巣様の構造が形成され、精巣様構造内では円形精子細胞が、卵巣様構造内では発育(fully grown) 卵核胞(GV)期卵が認められた(図3)。これらの卵・精細胞を用いて顕微授精を行うと、正常な産仔が生まれてくることから、配偶子として機能的に正常であるといえる。このように、マウスPGCから機能的に正常な雌雄配偶子を作出する簡便な実験系を樹立した。 今後は、この実験系を応用することで、ES細胞から誘導したPGCや、異種由来PGCからも安定して産仔を得ることが可能になると考えている。
Matoba S, Ogura A. Generation of functional oocytes and spermatids from fetal primordial germ cells after ectopic transplantation in adult animals. Biol. Reprod. 84: 631-838, 2011
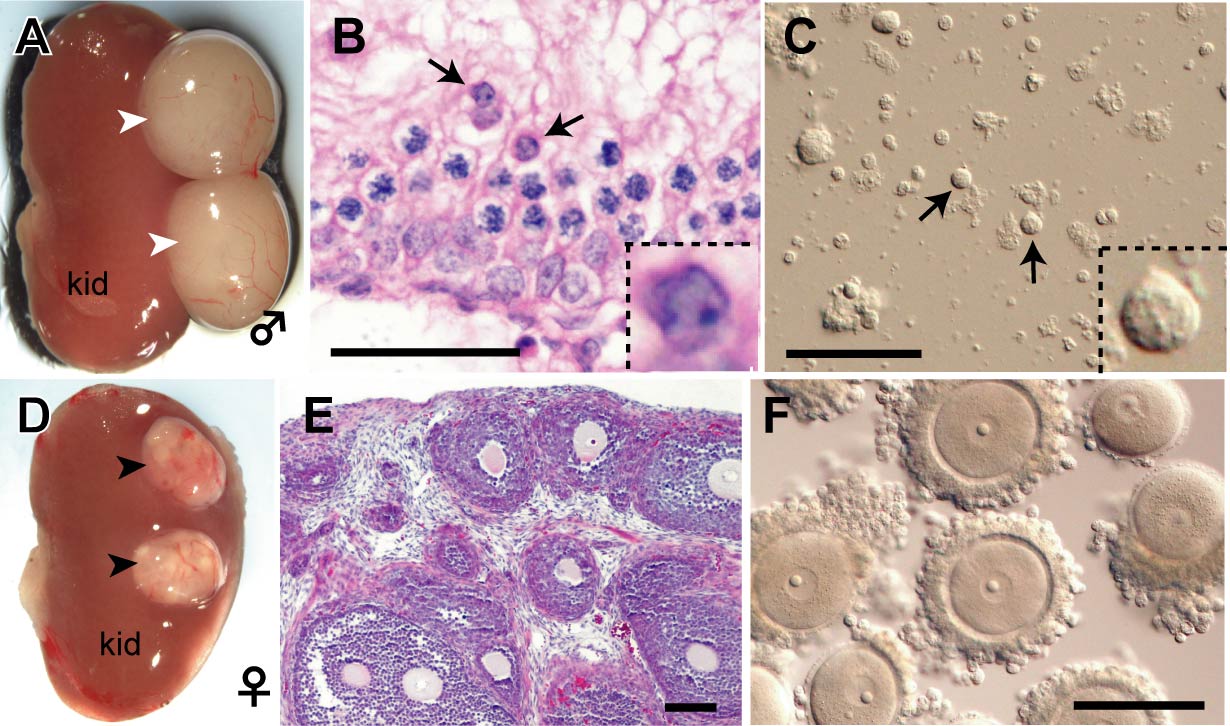
図3. マウスPGCを生殖腺体細胞とともに腎臓被膜下へ移植した後、4週目の腎臓
A-C: 雄, D-F: 雌。腎臓被膜下において移植片は体細胞の性別に従って、
それぞれ精巣・卵巣様の組織(矢頭)を形成した。精巣様組織内では円形精子
細胞(矢印)が存在する。卵巣様組織内ではGV卵が多数同期して発育している。
3.効率的な胚・配偶子の凍結保存法の開発
(1) 新規ガラス化保存 (HOV:High Osmolality Vitrification)
マウス胚の凍結保存法は緩慢法とガラス化法に大別されるが、当研究室では両方の利点を併せ持つHOV法(図4)を開発した。
この方法の利点:①保存操作は短時間ででき、簡単である。②加温操作は急ぐ必要がなく、緩慢法の融解手順に準じて行える。③これらの操作はすべて室温で行える。④-80℃で一定期間(2か月間以上)保存することが可能であり、ドライアイスを用いて国際輸送することができる。⑤主要な各近交系の2細胞期胚において高い生存率(93-100%)と産子発生率(33-82%)が得られる。⑥マウス2細胞期以外の胚や細胞への利用が期待できる。
理研ホームページ Current Technology のページへ
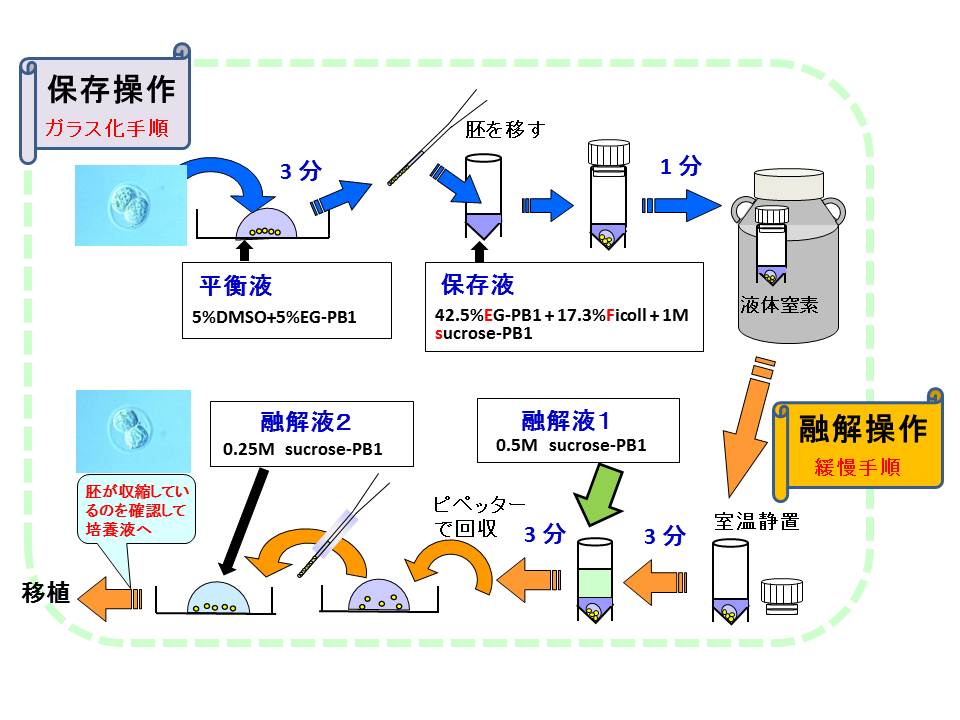
図4. HOV (High Osmolality Vitrification)法による胚の保存方法
(2) 凍結チューブを用いた簡便な精子凍結法の開発
マウス精子はプラスチックストローを保存容器として用いることで安定した成績で凍結保存できるが、誰にでも操作が簡単な凍結チューブを用いた凍結法を開発した。
この方法は、1 mlの凍結用コニカルチューブ(例:Nunc #366656)に0.01 mlの精子懸濁液(保存液:18%ラフィノース+3%スキムミルク水溶液)を分注し、液体窒素へ1 cm浸漬して凍結を行い、融解は室温に30秒間置いてから50℃で行うことでストローと変わらない生存性が得られた。C57BL/6Jでは体外受精率が24%であったが、媒精用培地に1 m M の還元型glutathione(GSH)を加えることで受精率は69%へ改善された。
Hasegawa A, Yonezawa K, Ohta A, Mochida K, Ogura A. Optimization of a protocol for cryopreservation of mouse spermatozoa using cryotubes. J Reprod Dev. (in press)
(3) 主要な各近交系における凍結精子を用いた体外受精法の開発
凍結精子を用いた体外受精では、精子の前培養培地(BSAをPVAで置き換えたHTF)へ0.4 mM methyl-beta-cyclodextrinを添加すると共に、媒精用培地(HTF)へ1 mM 還元型glutathione(GSH)を加えることで高い受精率を得ることができた。
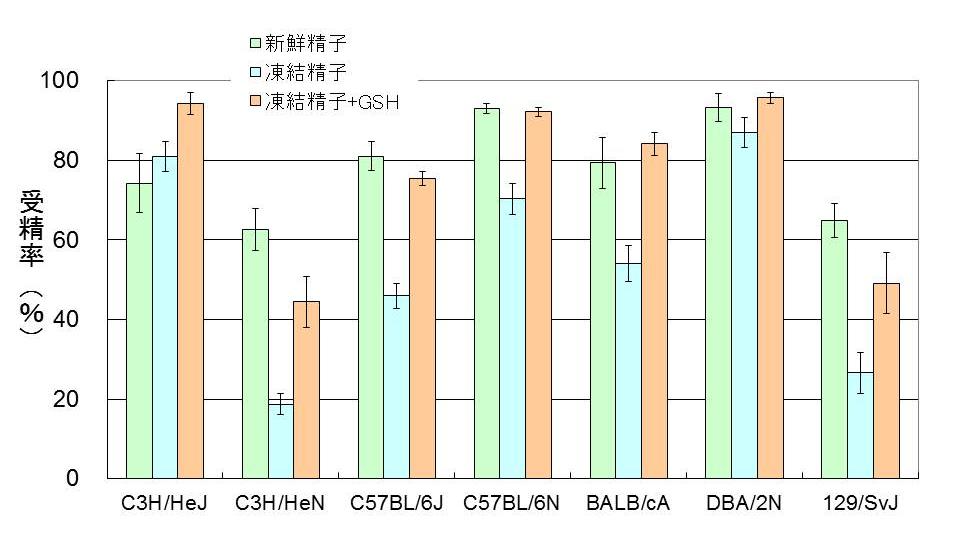
図5. 各近交系における凍結精子を用いた体外受精の成績
(4) 野生由来系統の過排卵処理および胚移植の改良による効率的な産子獲得法の開発
野生由来マウス系統であるMSM/Msは、従来の過排卵誘起法が効果的ではなく、更に胚移植によって産子が得られないため、次の技術開発を行った。過排卵処理は、eCGの代わりに抗インヒビン血清を5週齢の雌へ0.05 ml投与することで、従来の約5倍の24.3個の卵子を得る事ができた。更に体外受精によって得られた2細胞期胚をHOV法による凍結-融解後に偽妊娠雌ICRへICRの胚と混合移植し、4日後にcyclosporin Aを1mg/kgで皮下投与することで、MSM/Ms移植胚の29%が産子へと発生した。
4.新規幹細胞の確立
(1) 高品質なB6系統由来マウスES細胞の開発
我々はこれまでに野生種やクローンマウスなどからES細胞株を樹立し、貴重なバイオリソースとして提供してきた。一方で、最も基本的であるにもかかわらず、樹立が比較的困難とされてきたB6系統マウスからも、非常に高品質なES細胞株の樹立に成功した。このES細胞はマウスES細胞の培養条件を検討し、2i培地での培養により、もともと質の低いES細胞に生殖系列への寄与能を獲得させることができることを確認したものである(図6-A)。マウスやヒトだけでなく、様々な動物種から多能性幹細胞が樹立されている昨今の幹細胞分野において、ゴールドスタンダードとして機能させることができるバイオリソースと言える。
(2) ウサギ多能性幹細胞の樹立と利用法の開発
ウサギは実験動物として利用されてきた歴史が古く、薬理・免疫・安全性試験などで積極的に利用されてきた。また、霊長類よりもはるかに倫理的規制も少なく、実験動物としての基礎情報が豊富であり、コストも大幅に抑えることができ、繁殖も容易で受精や胚発生に関しても基礎的知見が充実している。妊娠期間も30日間と短く、多産であることからも、次世代への影響を解析する上で他の家畜や霊長類に比べて非常に有利である。我々はこのように実験動物として優れた特色を有するウサギからES細胞やiPS細胞の樹立に成功している。樹立したウサギES/iPS細胞はマウス多能性幹細胞とは異なり、その形態や未分化性維持機構がヒト多能性幹細胞に類似していることを証明した。この実験的事実は、ウサギが非常に扱いやすいヒト多能性幹細胞の前臨床モデル動物になりうる事を意味している。また世界初となるウサギiPS細胞の樹立にも成功した(図6-B)。これまでの世界的な研究から、ヒトiPS細胞はその不完全な初期化により、ヒトES細胞に比べて質が劣る場合が多く、再生医療実現の懸念材料となっているが、ウサギiPS細胞もウサギES細胞と比較すると、やはりヒトiPS細胞と同様の質の低さがあることが判明した。このことから、ウサギは実験動物としてマウスと同様の扱いやすさと、ヒトと類似したES/iPS細胞を樹立できるという優れた特徴を併せ持つことを証明できた。現在は、これらウサギ多能性幹細胞を用いて体外分化誘導能を指標にした評価系を構築している。今後はウサギ多能性幹細胞の質をより高め、最適な再生医療モデルの構築や遺伝子改変ウサギ作製を目指して研究を展開する予定である。
Honda A, Hirose M, Hatori M, Matoba S, Miyoshi H, Inoue K, Ogura A. Generation of induced pluripotent stem cells in rabbits: potential experimental models for human regenerative medicine. J Biol Chem, 285: 31362-31369, 2010.
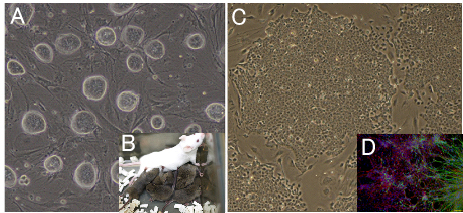
図6. 新規幹細胞の開発
(A) 2i処理を施したマウスES細胞。コロニーの形態は改善されている。
(B)実際に質の低いES細胞でも2i処理により生殖系列寄与能を獲得させることができた。
(C) ウサギiPS細胞。ウサギiPS細胞のコロニーはウサギES細胞のものとよく似ていた。
(D)ウサギiPS細胞の神経系への分化誘導。神経系への分化誘導試験でES細胞とiPS細胞の
質を評価することができる。
緑:Tuj1(神経繊維)、赤:GFAP(アストロサイト)
5.技術研修
平成24年度および25年度において、所外からの研修生を対象に以下の研修を行った。
- 24年10月 「マウス精子・胚の凍結保存方法に関する技術研修」
- 25年3月 「マウス精子・胚の凍結保存方法に関する技術研修」
- 25年11月 「マウス顕微授精技術に関する技術研修」
- 25年12月 「マウス顕微授精技術に関する技術研修」
